I sig. Pazienti che volessero in autonomia afferire alla Rete per ricevere specifiche prestazioni sanitarie sono pregati di inviare una richiesta tramite email all’indirizzo info@melanomanet.org ovvero di contattare il Contact Center al numero 080.5593674 (i nostri operatori saranno disponibili a risponderti, puoi metterti in contatto con l’organizzazione dal lunedì al venerdì dalle 9.00 alle 14.00 con orario continuato).
IL MELANOMA
Il melanoma è un tumore maligno caratterizzato dalla trasformazione neoplastica dei melanociti della cute, delle mucose o dell’uvea. Il melanoma è stato a lungo considerato un tumore raro sebbene la sua incidenza sia in costante crescita in tutto il mondo ed è circa raddoppiata negli ultimi 10 anni. Rappresenta la quinta e settima neoplasia a maggiore incidenza nei soggetti di sesso maschile e femminile rispettivamente, con una età di insorgenza tra i 44 e i 55 anni.
Di seguito vengono elencati i principali fattori di rischio di melanoma:
- Individui con fototipo chiaro (pelle, occhi e capelli chiari, con lentiggini)
- Elevato numero di nevi melanocitici comuni
- Presenza di nevi clinicamente atipici
- Presenza di nevi congeniti giganti
- Storia personale di tumori della pelle (melanoma e tumori cutanei non-melanoma)
- Fattori genetici (storia familiare di melanoma, storia familiare di elevato numero di nevi)
- Eritemi da esposizione solare soprattutto nell’infanzia
- Esposizione solare intermittente
- Uso di lettini e lampade solari
- Stati di immunodepressione (soggetti trapiantati d’organo od in trattamento con farmaci immunosoppressivi, HIV-positività)
- Età crescente
- Stato socio-economico elevato
- Xeroderma pigmentoso
L’eccessiva esposizione ai raggi UV solari e/o artificiali è uno dei maggiori fattori di rischio per lo sviluppo del melanoma e per la trasformazione maligna di nevi preesistenti.
Di seguito le principali raccomandazioni da seguire:
- L’utilizzo di creme solari ad alta protezione da applicare più volte al giorno
- L’esposizione deve essere ristretta a orari a più bassa intensità di raggi UV (dalle ore 8 alle ore 11 e dalle ore 16)
- Evitare scottature solari soprattutto in età infantile
- Evitare l’uso di lettini o lampade solari
- Sottoporsi a visite periodiche dermatologiche per il controllo dei nevi congeniti
Le lesioni cutanee considerate sospette devono essere valutate sia con l’esame obiettivo che tramite la Dermatoscopia.
Caratteristiche cliniche di riferimento, ma non patognomoniche del melanoma sono:
- Asimmetria della lesione;
- Bordi irregolari;
- Variegatura del colore;
- Diametro maggiore di 6 mm;
- Evoluzione irregolare, l’elevazione rispetto al piano cutaneo per la comparsa di nodularità e l’evoluzione delle caratteristiche morfologiche nel corso del tempo, tra cui anche la regressione di parti della lesione.

Melanoma: varianti più comuni
A Melanoma a diffusione superficiale
B Melanoma nodulare
C Melanoma lentigginoso
D Melanoma amelanotico
Indicazioni alla Dermatoscopia digitale
- Diagnostica differenziale di lesioni pigmentate melanocitarie e non-melanocitarie
- Lesioni non pigmentate
- Monitorare multipli nevi melanocitici, piani, non palpabili con caratteri di atipia ma senza evidenza di criteri specifici
Le lesioni cutanee sospette devono essere sottoposte a biopsia escissionale a scopo diagnostico e, in caso di lesione maligna, ad eventuale ampliamento. Qualora indicato ai fini di una corretta stadiazione, seguiranno biopsia del linfonodo sentinella e linfadenectomia.
PRIMA FASE: BIOPSIA ESCISSIONALE
Un’escissione con 5 mm di margine è mandatoria e sufficiente per garantire la corretta e completa asportazione del melanoma per un’accurata valutazione istologica. In corso di biopsia escissionale sono controindicati lembi cutanei ed innesti.
SECONDA FASE: AMPLIAMENTO E BIOPSIA DEL LINFONODO SENTINELLA (BLS)
L’ampliamento deve essere eseguito preferibilmente entro 4-6 settimane dalla prima escissione.
La biopsia del linfonodo sentinella deve essere eseguita a tutti i pazienti che abbiano un melanoma primitivo con spessore uguale o superiore a 0.8 mm o a tutti i melanoma che presentino ulcerazione. La BLS si esegue contestualmente alla esecuzione della linfoscitingrafia e consiste nell’asportazione dei linfonodi drenanti il sito di insorgenza del melanoma.
TERZA FASE: LINFOADENECTOMIA
La dissezione linfonodale completa non dovrebbe più essere indicata in caso di linfonodo sentinella positivo, è invece raccomandata in caso di metastasi linfonodali clinicamente evidenti all’esame obiettivo, all’ecografia e/o alla TAC.
Il numero dei linfonodi esaminati definisce l’adeguatezza dell’intervento eseguito e varia a seconda del distretto linfatico interessato.
Tali fasi sono seguite dall’elaborazione di una carta d’identità del melanoma specifica per singolo paziente caratterizzata da:
- Diagnosi Istologica (secondo i criteri SIAPEC)
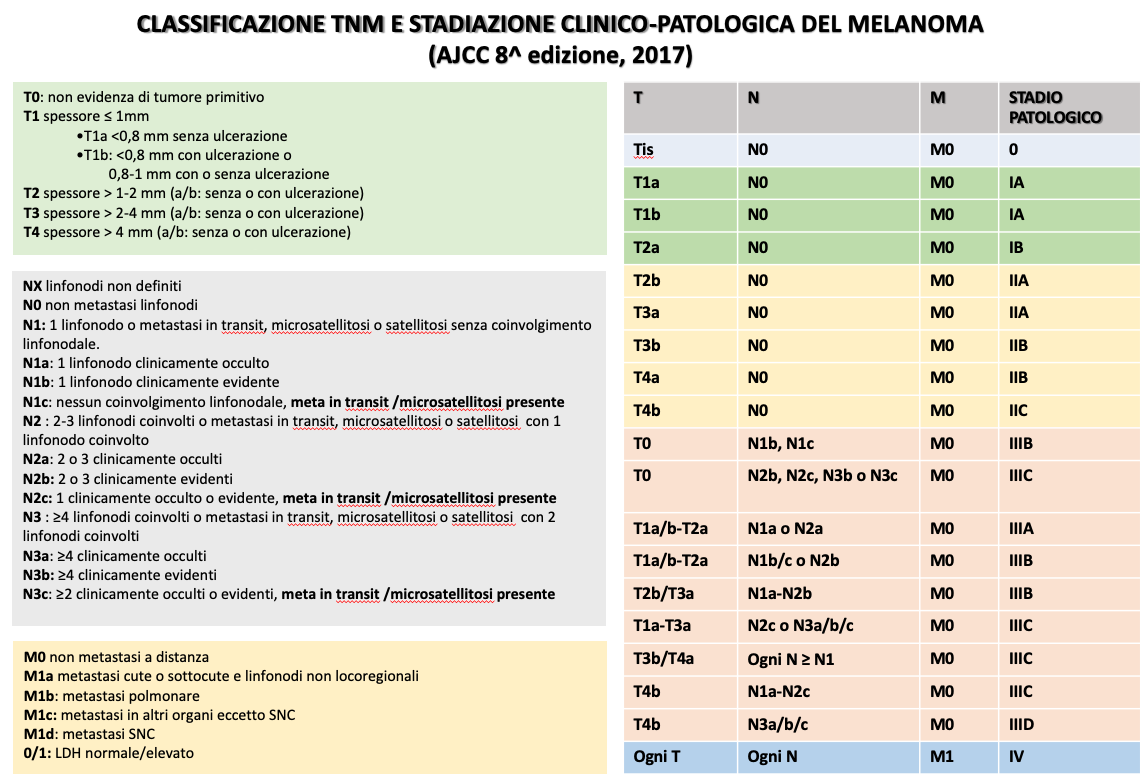
- Classificazione TNM e stadiazione (secondo i criteri AJCC)
- Profilo genetico-molecolare
- Profilo immunologico
Tali parametri saranno utili a identificare il rischio del paziente di recidiva e/o progressione allo scopo di individuare il follow-up clinico-strumentale più appropriato.
Diagnosi Istologica (secondo i criteri SIAPEC)
Trattasi di descrizione macroscopica e microscopica della lesione sospetta secondo questi parametri:
Esame macroscopico
Dimensioni (diametro in cm)
Pattern di crescita (lesioni in chiazza/in placca/nodulare/ecc.)
Colore (brunastro/ardesiaco/ecc.)
Tipo di pigmentazione (uniformemente/disuniformemente pigmentata/con aree ipocromiche/ecc.)
Margini (ben definiti/mal definiti/policiclici/ecc.)
Morfologia (tondeggiante/ovalare/ecc.)
Varianti istologiche: acrolentiginoso, lentigo maligna, verrucoso/polipoide
Tipi rari: desmoplastico neurotropico, nevo blu maligno.
Esame microscopico
Istotipo (a diffusione superficiale/nodulare/acrale/lentigo maligna)
Fase di crescita (radiale/verticale)
Spessore di Breslow
Livello di Clark
Ulcerazione: presente/assente
Indice mitotico
Linfociti infiltranti il tumore (assenti/presenti/brisk/non brisk)
Infiltrazione linfocitaria peritumorale: assente/scarsa/moderata/interna (“brisk”)
Regressione: presente/assente
Microsatellitosi: presente/assente
Invasione linfovascolare: presente/assente
Margini di resezione: indenni/interessati da localizzazioni neoplastica
Le principali alterazioni genetico-molecolari più frequentemente osservate si possono sintetizzare nel seguente modo secondo la sede cutanea di insorgenza del melanoma cutaneo primitivo e dei livelli di esposizione solare (vedi figura successiva).
Melanoma acrale
Mutazioni ± amplificazione di c-KIT; amplificazione di CDK4 o CCND1 (associata ad aumento dei livelli di espressione delle relative proteine); amplificazione delle regioni genomiche 11q13, 22q11-13 e 5p15.
Melanoma della regione testa-collo e delle aree cutanee esposte cronicamente al sole (CSD)
Amplificazione di CDK4 e/o CCND1; aumento dei livelli di espressione della proteina p53; mutazioni ± amplificazione di c-KIT (in circa il 5% dei casi).
Melanoma del tronco e delle aree cutanee non esposte cronicamente al sole (non-CSD)
Mutazioni di BRAF o NRAS, con eventuale coesistenza delle alterazioni molecolari associate alle mutazioni BRAF, tendenza alla riduzione nell’espressione della proteina p53; presenza di specifiche variazioni polimorfiche del gene MC1R.
Melanoma mucosale
Mutazioni di cKIT sono circa il 30%, seguiti da mutazioni di NRAS e da una minima percentuale di BRAF.
Indagini specifiche sono da avviarsi in caso di sospetto di ereditarietà o in caso di melanomi multipli
Melanoma familiare
Due o più parenti affetti, appartenenti allo stesso ramo parentale
- Melanoma multiplo
- Insorgenza al di sotto dei 35 anni
- Presenza nella famiglia di altre neoplasie correlate (tumore del pancreas e tumore della mammella, mesotelioma)
La predisposizione genetica si eredita secondo modalità autosomica dominante con penetranza incompleta ed espressività variabile; ogni individuo portatore di mutazione, ha una probabilità del 50% di trasmettere l’alterazione ai propri figli.
I geni maggiormente studiati sono : CDK4, CDKN2A, MITF1.
Melanomi multipli
Si intende la presenza di più casi di melanoma nello stesso paziente.
I geni analizzati sono : MC1R e CDK4.
Caratterizzazione oncogenomica

Curtin JA et al. Somatic Activation of KIT in Distinct Subtypes of Melanoma. JCO 2006
Tacastacas JD et al. Update on primary mucosal melanoma. J Am Acad Dermatol 2014
Maldonado JL et al. Determinants of BRAF Mutations in Primary Melanomas. J Natl Cancer Inst 2003
Il follow-up clinico strumentale viene stabilito dopo una valutazione collegiale e previo completamento delle fasi diagnostiche e di stadiazione nonché della caratterizzazione immunologica e genetico-molecolare del singolo paziente.

TRATTAMENTO ADIUVANTE
I pazienti che vengono definiti “ad alto rischio” possono beneficiare di un trattamento adiuvante al fine di prevenire recidiva di malattia. Il farmaco sinora utilizzato è stato l’Interferone alpha, somministrato a dosaggi e per un arco di tempo variabili a seconda del tipo di rischio. Da pochi mesi è invece possibile usufruire di terapie adiuvanti con farmaci di ultima generazione (anti-PD-1 o farmaci a bersaglio molecolare ad attività anti-BRAF ed anti-MEK) già applicati nella pratica clinica nella malattia metastatica.
TRATTAMENTO IN FASE METASTATICA
Grazie all’avvento dell’immunoterapia e della targeted therapy, il melanoma non è più considerato un tumore orfano di terapie. I nuovi farmaci da un lato potenziano la risposta immunitaria anti-tumorale e dall’altro lato agiscono inibendo le molecole-chiave coinvolte nei meccanismi di proliferazione e progressione cellulare che risultano iperattivate negli stadi avanzati di malattia (principalmente le MAP chinasi).
I pazienti affetti da melanoma metastatico hanno la possibilità di essere trattati con Immunoterapici ad attività anti-PD-1 (Nivolumab, Pembrolizumab) o anti-CTLA-4 (Ipilimumab), inibitori di BRAF e di MEK (Vemurafenib e Cobimetinib o Dabrafenib e Trametinib) o di afferire a terapie sperimentali nell’ambito di trials clinici variamente distribuiti presso i Centri di Riferimento Nazionali (vedi trials clinici attivi nel nostro Centro).